巨赤芽球性貧血を礎にMDSの研究を牽引
日血機関誌の編集を22年、英文誌の地位を固める(前編)
吉田彌太郎(医仁会武田総合病院 顧問)
2021.09.30
「この人に聞く」のシリーズ第16回は、武田総合病院顧問の吉田彌太郎先生にお話をうかがいました。京都大学の学生時代に鉄代謝に魅せられ、卒業後は巨赤芽球性貧血の研究の道に進み、その成果を礎に骨髄異形成症候群(MDS)の研究者として国内外で多くの研究成果を報告してきました。一方で、22年の長きにわたり、日本血液学会機関誌の編集に携わり、同誌の英文誌化に尽力し、世界有数のIFを誇る学術誌『IJH』の地位を固めました。「注目を浴びるオリジナル原著を、ぜひIJHに投稿してほしい」と願っています。
吉田彌太郎(医仁会武田総合病院 顧問)

1935年9月生まれ。京都市出身。1960年3月京都大学医学部卒業。66年同大大学院修了。68年1月〜71年3月までカナダ・マクギル大学留学。71年5月より関西電力病院勤務。74年金沢医科大学血液・免疫内科助教授。79年4月京都大学医学部講師(輸血部、第一内科)。1996年2月京都大学東南アジア研究センター人間環境部門(臨床医学)教授。99年4月武田総合病院副院長、2005年4月より同病院長。08年4月同院血液病センター、17年4月より現職。日本血液学会理事、日本リンパ網内系学会理事などを歴任。1979年〜2001年まで日本血液学会機関誌『International Journal of Hematology』の編集長を務める。
臨床講義での鉄代謝の話から血液の道へ
B12投与でDNA合成休止細胞の消失を見出す
私は京都生まれ京都育ちで、親戚には医師が多く、祖父母や両親の希望などもあり、自然な流れで京都大学に進学し、医師となりました。血液内科を志したのは、医学部6年生の臨床講義で第一内科の脇坂行一先生がお話しされた、貧血患者の鉄代謝を放射性同位元素で標識した59Feを用いて明らかにした研究に魅せられたのがきっかけでした。静注された59Feは骨髄でHbを合成中の赤芽球に速やかに取り込まれます。鉄の血中消失時間は赤血球造血が盛んだと短く、低下していると延長するという内容でした。
それまで血液学といえば、血液像という血球形態を調べるスタティックなものでした。この講義で私は初めて、血液中の鉄が赤芽球に取り込まれ、赤血球として再び血液中に出現するというダイナミックな血液学を知りました。このような鉄代謝は系統講義でも教科書でも見聞きしたことがなく、脇坂先生の講義は、鉄を指標とした代謝を介して赤血球の産生と崩壊という造血動態の動的評価を可能にした、細胞生物学的な血液学の幕開けでした。
卒業後はインターンとして1年間大阪の住友病院に勤務しました。住友病院では時間があればもっぱら臨床検査室に入り浸り、血球の塗抹標本の検鏡や珍しい検査の見学に明け暮れました。そして、全身を診る内科として京大第一内科を選び、大学院に進みました。
大学院では脇坂先生や講師の内野治人先生のもとで、まず巨赤芽球性貧血の病態生理の解明に取り組みました。悪性貧血に代表される巨赤芽球性貧血は、ビタミンB12欠乏性貧血で、1948年にB12が発見されるまで治療法がなかったことから悪性貧血と呼ばれ、今もその名前は残っています。この病気の骨髄像を見た人は、必ずや巨赤芽球の“悪魔的美しさ”に魅せられると思います(図)。大型の核の中に微細な砂利を敷き詰めたようなクロマチン、そしてHbの合成が始まり細胞質がやや灰色になってもクロマチンは細かい砂を振り撒いたように見えます。
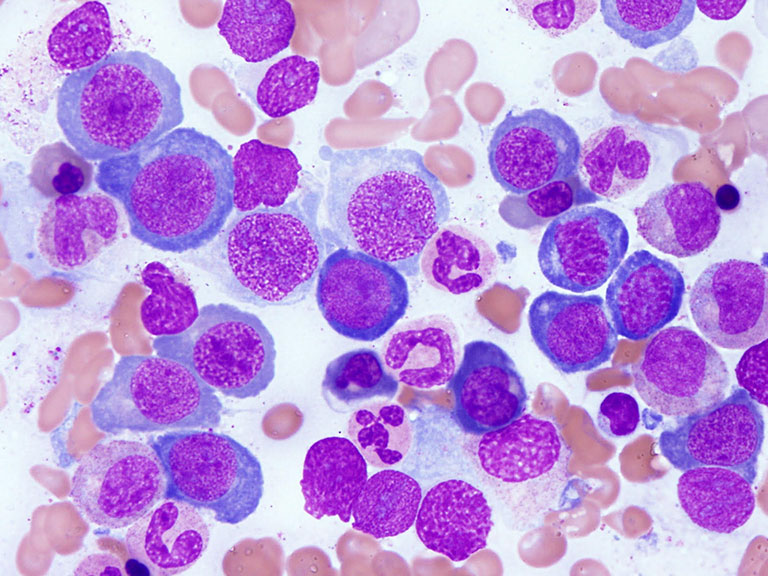
私は、なぜ赤芽球が大型化し核が繊細化するのかについて調べました。巨赤芽球の核のDNA量を顕微分光法で一個一個測定し、その結果、DNA合成期の細胞と分裂前期(G2期)の細胞が相対的に多いことが分かりました。そこで、これらの骨髄細胞を事前にトリチウムチミジン(3H TDR)と前培養し、その同一細胞で顕微分光法によるDNA量と、autoradiography による3H TDRの取り込みの有無とを同時に評価する方法を開発しました。
その結果、DNA合成期にありながら3H TDRを取り込まない巨赤芽球が多数あることが明らかになりました。これはDNA合成のarrest であり、他の疾患や対照の赤芽球では観察されません。さらに、DNA合成のarrest 変化はごく少量のB12の投与によって消失し、巨赤芽球も消失したのです。一方で、RNA合成や蛋白合成ではarrest は認められなかったことから、細胞の核だけが、DNA合成の停止を含めた合成時間の延長により、核が巨大化すると考えられました。この結果は1968年のBlood誌に掲載されました。
MDSでもう一つの巨赤芽球性貧血と出合う
国際シンポジウムで研究成果を毎年報告
その後3年間カナダに留学し、帰国後は関西電力病院に勤務し、新設の金沢医科大学に赴任しました。1979年4月に母校の第一内科に戻り、内野先生が班長を務めていた厚生省特発性造血障害調査研究班の班員として、再生不良性貧血の免疫発生機序と免疫抑制療法について研究しました。
1982年に欧米の血液研究者グループ(FAB)がMDSという名称と病型分類を提唱しました。これは不応性貧血と前白血病の2つの病態が統合されたものとして、Hematopoietic Dysplasiaという名称を経て提唱された概念です。このMDSの貧血では、悪性貧血よりも巨赤芽球性貧血が高頻度にみられますが、MDSの巨赤芽球は悪性貧血ほどの形態的特徴には乏しく、赤芽球のごく一部にみられる程度で、DNA合成arrestも見出されていませんでした。
わが国ではFAB分類の提唱を機に、1983年、厚生省特発性造血障害調査研究班の中に、MDS研究のための不応性貧血分科会が立ち上げられました。私は分科会長として日本の過去の症例の収集を開始し、FAB分類のRA、RARS、RAEB、RAEB-t、CMMLそれぞれの予後について解析を進め、国際的研究組織であるMDS Foundationが主催する国際MDSシンポジウムでその結果を報告しました。このシンポジウムに私は第1回から第9回まで毎回参加し、発表してきました。わが国のMDSの臨床研究は、国単位の資料として貴重なものだと思っています。

左から、Dr. D Hoelzer(フランクフルト大学)、Dr. T Hamblin(サウスハンプトン大学)、私。
MDSは複数の遺伝子変異の集積により発症し、骨髄では細胞が多く(骨髄過形成)、末梢血では汎血球減少がみられ、この現象は従来、無効造血と呼ばれてきました。また、病型によってリスクの違いはありますが、急性白血病に進展しやすい疾患です。私たちはこれらのメカニズムを解明するために、MDS患者さんの骨髄細胞を半流動培地で培養し、培養途上の細胞集塊をマッピングして、骨髄集塊内の細胞数を算定するシステムを考案しました。
その結果、MDSでは培養初期は細胞集塊内の細胞数が一旦増えるのですが、培養日数とともに生存細胞数が次第に減少することが確認できました。正常骨髄では造血幹細胞は増殖と分化を続け、細胞集塊内の細胞数は増え続けます。しかし、MDSでは培養後半の細胞増殖や分化がなく、細胞死、つまりアポトーシスが起きていたのです。アポトーシスはプログラムされた生理的細胞死で、日常的に寿命の尽きた成熟血球などもアポトーシスしています。しかしMDSでは、これが病的に過剰に起きているというのが、私たちの結論であり、このMDSの無効造血を過剰アポトーシスとする仮説を1993年の『Leukemia』誌に発表し、1994年の第3回国際MDSシンポジウムでも講演しました。なお、MDSからの急性白血病発症では、白血病芽球細胞はアポトーシスにはなりにくい細胞群であり、汎血球減少のMDSとその最終段階の急性白血化はアポトーシスにおいては正反対の性格を示し、このことを1995年の『Leukemia Research』誌に発表しました。
〈後編では、1991年に英文誌化された日血会誌「International Journal of Hematology(IJH)」の成り立ちや当時のご苦労についてお話しいただきました。〉