血友病Aにおける第Ⅷ因子の研究を40年
“夢のような”治療薬エミシズマブの創出へ(後編)
嶋緑倫(奈良県立医科大学 小児科学教室 教授)
2019.10.10
嶋緑倫(奈良県立医科大学 小児科学教室 教授)

1979年奈良県立医科大学卒業、同大小児科研修医、研究生。81年奈良県立五條病院小児科医員。83年奈良医大第2病理学教室助手。86年奈良医大医学博士号取得。87年米国・カリフォルニア州サンディエゴ市スクリプス研究所のリサーチフェローに。89年奈良医大小児科助手、90年同講師、93年同助教授を経て、2009年より現職。14年同大先端医学研究機構長、産学官連携推進センター長。15年同大血友病治療・病態解析学講座教授兼任。
第Ⅷ因子の定期補充療法で出血頻度は減少
しかし生涯にわたる関節症の発症予防は困難
第Ⅷ因子の研究成果を引っ提げ、1989年に帰国しました。遺伝子工学の進歩により血友病治療製剤の開発は急速に進み、すでに1984年に『Nature』誌に遺伝子組み換え第Ⅷ因子の作製が発表され、1993年には遺伝子組み換え製剤が登場しました。2000年代から、わが国でも第Ⅷ因子製剤を定期的に注射して出血を予防する定期補充療法が普及することとなりました。標準型第Ⅷ因子製剤では週3回あるいは隔日に静脈注射することにより、第Ⅷ因子活性の最低値(トラフ)を1~3%以上に維持することで出血頻度を大きく減少させることが可能になったのです。2018年には、重症血友病Aの患者さんに対する定期補充療法の実施率は9割近くに達しています。
しかしながら、特に幼少期の週3回や隔日の静脈注射は、患者本人のみならず家族にも負担です。通常は週1回の通院での静注から始めます。時間をかけてそれを週2回、3回へと段階的に増やし、その間に家族に静注の指導をします。最初は病院で医師や看護師の指導を受けながら、子どもの血管に針を刺すことができるまで手技を覚えてもらいます。次は、在宅で静注ができるように、少しずつ移行していきます。そして本人の成長につれ、やがては自分で静注ができるように指導していくのです。何年もかかります。2014年には半減期が延長した遺伝子組み換え第Ⅷ因子製剤が登場し、週3回や隔日投与から週2回へと頻度を下げられるようになりましたが、患者さんや家族の負担は依然残っています。
こうして定期補充療法を続けても、開始後26年の観察期間で30〜40歳の患者の90%に関節症がみられるとの報告があり、現行の定期補充療法では関節症の発症を完全に防ぐことはできないと考えられています。
血友病Aの治療におけるもう一つの大きな課題が製剤中の第Ⅷ因子に対する同種抗体(インヒビター)の発生です。インヒビター陽性例では、第Ⅷ因子製剤による補充療法はほとんどの症例で無効になります。そのために、止血のコントロールが難しくなり、患者さんのQOLは大きく低下します。少し話は遡りますが、私が研修医時代に主治医となっていたインヒビター陽性の患者さんが、ある朝「首が腫れている」と言って受診し、出血があることがわかり、すぐに入院されたのですが、その晩、頸部の出血による窒息で亡くなりました。こうした原体験も、インヒビターを有する患者さんの治療法を開発したいと考えるきっかけになっていました。


エミシズマブ投与により出血頻度が激減
インヒビター陰性の小児での有効性も検討中
臨床現場でこうしたモヤモヤも抱えている中、2003年に、中外製薬の研究者が奈良医大を訪れました。目的は、第Ⅷ因子の機能を有するバイスペシフィック抗体のデータの説明と血友病Aの臨床応用の意義についてでした。本抗体が、延長した血友病A患者血漿の凝固時間を短縮する作用を有することがわかり、私は興奮しました。そして、即座に共同研究の開始を決定しました。2005年に国際血栓止血学会で、2006年には国際血友病学会でその研究結果を発表しました。当初、製剤化までそれほどの時間はかからないと考えていたのですが、動物実験でその有効性が証明できず、最初のバイスペシフィック抗体の開発は中止せざるを得ない状況になりました。
しかしながら、中外製薬の研究チームはさらにポテンシャルの高い抗体の作製に再チャレンジし、抗体機能の改良や生産効率の向上などの技術を積み上げていきました。そして、第Ⅷ因子中和抗体を投与して確立したカニクイザルの後天的血友病Aモデルを用いて、バイスペシフィック抗体の止血効果を証明することができたのです。その後、生産性を高めるいくつかの技術を導入することで最終抗体、ACE910(エミシズマブの開発名)を得ることができました。ACE910の安全性と薬物動態を調べるために健常人を対象とした第Ⅰ相臨床試験を日本で実施しました。さらに、この第Ⅰ相臨床試験で、探索的研究としてインヒビター保有、非保有血友病A患者を対象としてACE910の週1回の皮下投与による出血抑制効果を検討しました。本試験では0.3、1.0および3.0mg/kgの3用量で実施しましたが、いずれの投与群でも出血頻度は投与前と比較して著明に減少することがわかりました。また、この効果は延長試験でも維持されることがわかりました。わが国で実施された第Ⅰ相臨床試験をもとに2015年11月から国際第Ⅲ相臨床試験が開始されました。まず、HAVEN1試験では、12歳以上の血友病Aインヒビター陽性の109例が参加、無作為に週1回のエミシズマブ投与群と非投与群に分け、評価しました。その結果、エミシズマブ群の治療を要する年間出血回数中央値は2.9で、非投与群より87%減少しました。さらにエミシズマブ群では63%の患者で治療を要する出血回数が0でした。これらの結果は、エミシズマブによりインヒビターを保有する血友病Aでも「出血ゼロ」を目指せることを示す大きな研究成果となりました。
続いて2016年6月から、12歳未満の小児インヒビター陽性患者を対象にしたHAVEN2試験が実施され、88例が参加しました。非介入観察研究を実施した患者13例中、12例でバイパス止血製剤の定期投与が行なわれていましたが、エミシズマブ投与後は治療を要する出血を来したのは2エピソード/2例のみで年間出血回数の減少率は99%に上りました。エミシズマブによる出血抑制効果は小児患者でより顕著であることが明らかになりました。
さらに、12歳以上のインヒビター陰性血友病Aを対象に、定期補充療法とエミシズマブの有効性を比較したHAVEN3試験では、定期補充療法と同等以上の出血抑制効果が確認されました。
HAVEN4試験では、4週に1回投与の有効性を比較し、4週ごとの皮下投与でも同等の出血抑制効果が認められました。さらに、インヒビター陰性の今までに治療歴のない患者を含む小児での安全性と有効性に関する臨床試験(HOHOEMI試験)もわが国で実施し、有効性と安全性が確認されました。
エミシズマブは、第Ⅷ因子(FⅧ)ではなく、活性型第Ⅷ因子(FⅧa)の機能を代替する抗体で、全く新しい概念で開発された抗体医薬です。FⅧはトロンビンや活性型第Ⅹ因子(FⅩa)によってFⅧaに変換されて補因子機能を発揮します。FⅧaの存在下では活性型第Ⅸ因子(FⅨa)による第Ⅹ因子(FⅩ)活性化反応は約20万倍に増幅され、爆発的なトロンビンの生成が行なわれ、安定したフィブリンが形成されます。
エミシズマブは、FⅨaとFⅩの両方に結合してFIXaおよびFXを精緻に架橋することによってFⅧaの補因子機能を代替します。はじめからFⅧaの機能を代替しているので、FⅧのようにトロンビンやFⅩaによる活性化の必要性がありません。FⅨaとFⅩが存在すれば凝固活性を直に発動できるのです。しかも陰性電荷を有するリン脂質の存在下でないとその作用を発現できません(図1)1)。陰性電荷リン脂質の供給源は活性化血小板であることから、エミシズマブは出血部位にしか作用しません。また、FⅧ製剤と異なり、インヒビターを直接誘導することがなく、インヒビターが存在しても出血抑制効果には全く影響がないことも確認されています。さらに、エミシズマブは半減期が約30日と、他の抗体医薬と比べて非常に長いため、最長で4週に1回の皮下注射で効果を発揮します。
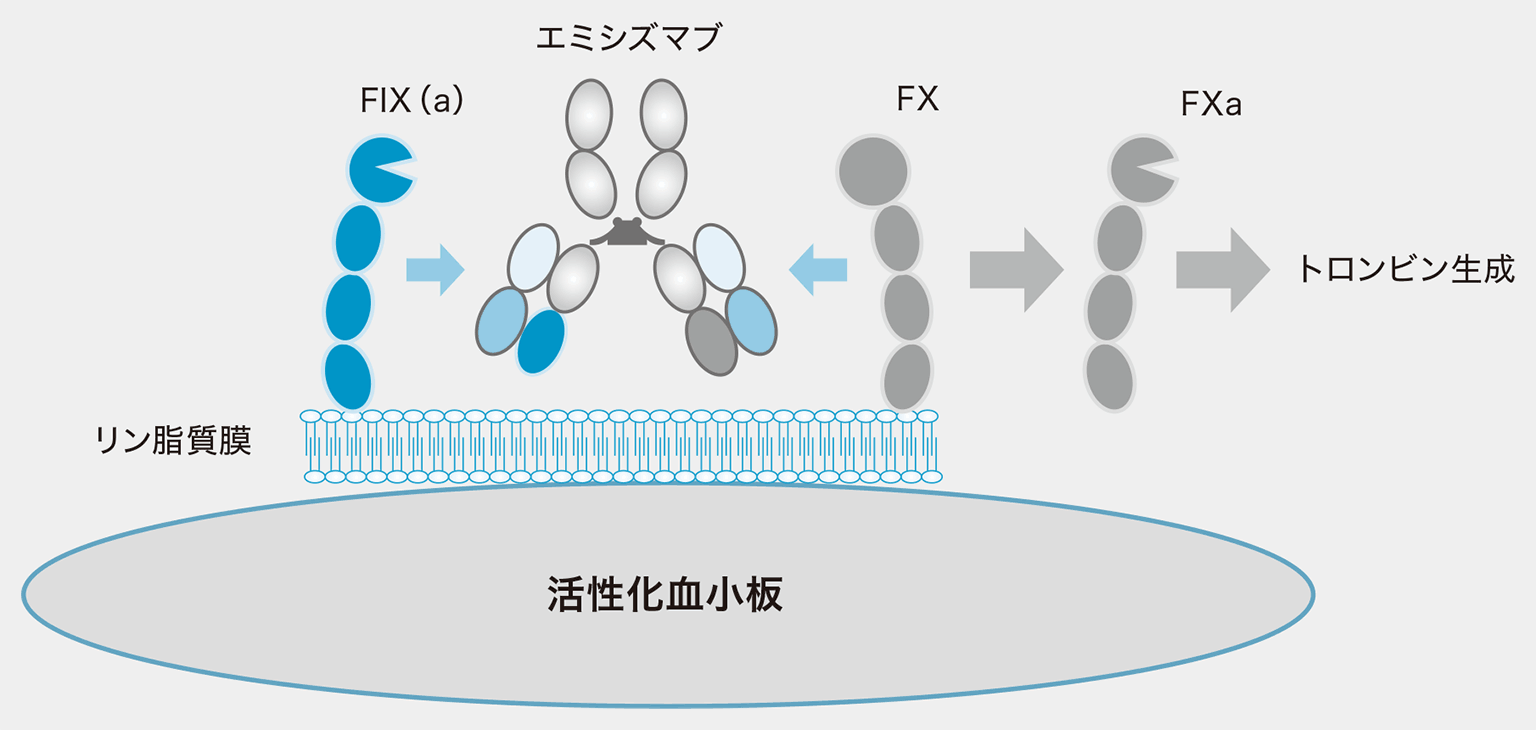
血友病Aの患者さんは、長期間にわたり、第Ⅷ因子製剤の定期補充療法を受けてきました。出血は減ったものの、関節症は進行するために活動性の低下を招きやすいのが現状です。エミシズマブの登場により、子どもは製剤を持参せず修学旅行に行けるようになり、働き盛りの人は長期出張が可能になりました。出血リスクが激減することで、患者さんは「出血の不安なく暮らせる」「自分が血友病だということを忘れた」とも話してくれます。
エミシズマブの共同開発が実現できたのは、医師になったときから血友病患者さんのニーズを把握し、少しでも良くなってほしい、新しい薬ができたら喜んでほしいという思いを持ち続けたことと第Ⅷ因子についての研究を継続してきたことが結実したからだと思います。
研究を続けていると苦しい時期もありますが、諦めてはいけません。強い思いを持っていれば、良い方向に動き始めるきっかけが必ずあると思います。
1) 嶋緑倫. 小児内科. 2018; 50(10):1495-1499.